 Ученые ФИЦ Биотехнологии РАН совместно с исследователями из МГУ имени М.В. Ломоносова и Института биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова описали структуру молекулярного комплекса, образующегося при взаимодействии никотинового ацетилхолинового рецептора и белка из семейства 14-3-3. Подобные взаимодействия лежат в основе передачи и восприятия сигналов между нервными клетками, обеспечивая правильную работу нервной системы. Результаты исследования опубликованы в журнале Biochemical and Biophysical Research Communications. Исследование выполнено в рамках проекта федеральной научно-технической программы развития синхротронных и нейтронных исследований и поддержано национальным проектом «Наука и университеты».
Ученые ФИЦ Биотехнологии РАН совместно с исследователями из МГУ имени М.В. Ломоносова и Института биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова описали структуру молекулярного комплекса, образующегося при взаимодействии никотинового ацетилхолинового рецептора и белка из семейства 14-3-3. Подобные взаимодействия лежат в основе передачи и восприятия сигналов между нервными клетками, обеспечивая правильную работу нервной системы. Результаты исследования опубликованы в журнале Biochemical and Biophysical Research Communications. Исследование выполнено в рамках проекта федеральной научно-технической программы развития синхротронных и нейтронных исследований и поддержано национальным проектом «Наука и университеты».
В мембранах нервных клеток есть различные типы рецепторов, которые обеспечивают передачу тех или иных сигналов — по сути, «коммуникацию». Одни из таких молекул — никотиновые ацетилхолиновые рецепторы, — активируются ацетилхолином и никотином и участвуют в пластичности нейронов и формировании памяти. При нарушении функции этих рецепторов у человека могут возникнуть различные нейропатологии.
Исследования показали, что никотиновые ацетилхолиновые рецепторы (н-холинорецепторы) вовлечены в целый ряд взаимодействий с внутриклеточными белками и подвергаются различным химическим модификациям, регулирующим такие взаимодействия. Так, например, фермент протеинкиназа «навешивает» на них фосфатный остаток, и именно в таком — фосфорилированном — состоянии с рецептором начинают взаимодействовать белки семейства 14-3-3. Однако до сих пор не до конца ясно, как именно происходит этот процесс, и какие участки связывания на рецепторе отвечают за него.
Чтобы понять это, коллектив ученых из ФИЦ Биотехнологии РАН совместно с исследователями из МГУ имени М.В. Ломоносова, Института биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова описали структуру молекулярного комплекса, образующегося при взаимодействии никотинового ацетилхолинового рецептора и белка 14-3-3.
Ученые выделили в чистом виде нативные н-холинорецепторы из нервной ткани мыши и обработали их протеинкиназой, чтобы изучить роль фосфорилирования. Авторы научной работы продемонстрировали, что фосфорилированные рецепторы взаимодействуют с белками 14-3-3, образуя комплекс.
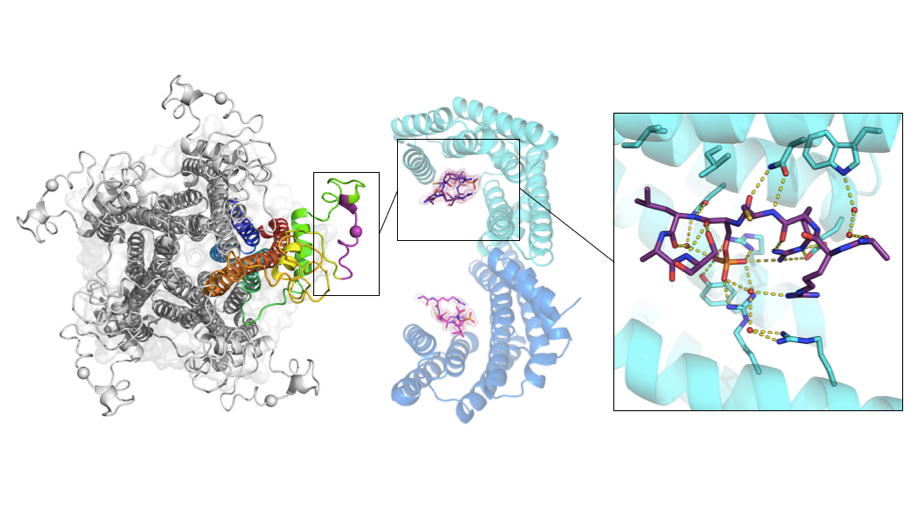
Чтобы идентифицировать участок, по которому 14-3-3 узнают рецептор, исследователи провели биоинформатический анализ его аминокислотной последовательности. Наиболее вероятным для узнавания оказался участок вокруг остатка серина-365, аминокислотная последовательность которого хорошо соответствует мотиву узнавания 14-3-3 и который, по данным литературы, подвергается фосфорилированию in vivo. Данная последовательность находится в составе длинной цитоплазматической петли рецептора, которая выполняет важную регуляторную роль, поскольку подвергается различным модификациям и служит местом связывания с целым рядом белков-партнеров.
Для понимания молекулярных основ взаимодействия между 14-3-3 и н-холинорецептором, коллектив ученых из ФИЦ Биотехнологии РАН под руководством д.б.н. Н.Н. Случанко, сконструировал «химерный» белок, состоящий из 14-3-3 и «слитого» с ним фрагмента рецептора, содержащего в центральном положении остаток серина-365. Фосфорилирование данного остатка в составе фрагмента рецептора приводило к образованию комплекса с белком 14-3-3. Расшифровка кристаллической структуры этого комплекса с высоким разрешением помогла объяснить механизм его образования.
«Наше исследование раскрывает ранее неизвестные нюансы регуляции никотиновых ацетилхолиновых рецепторов, которые, судя по всему, играют важную роль в нормальном функционировании нервной системы млекопитающих. С практической точки зрения знать, как организован описанный нами молекулярный комплекс между рецептором и белком 14-3-3 важно, поскольку потенциально его можно использовать в качестве мишени для подбора лекарственных препаратов, направленных на лечение патологий нервной системы», — рассказывает Кристина Тугаева, младший научный сотрудник группы «Белок-белковые взаимодействия» ФИЦ Биотехнологии РАН.